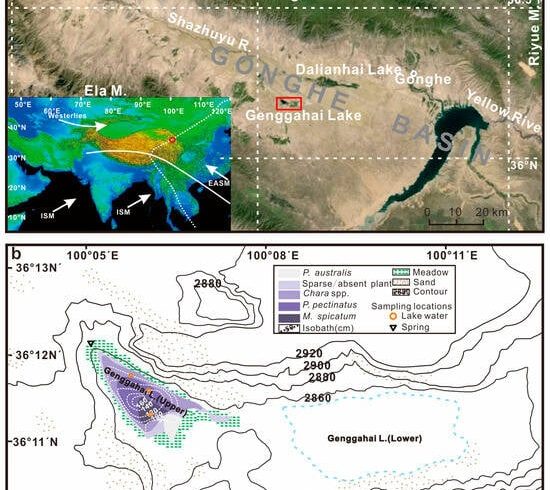
۵٫۱٫ عوامل موثر بر δ۱۳سیDIC در بدنه های آبی حوضه GGH
چندین فرآیند اصلی بر ترکیبات ایزوتوپ کربن پایدار DIC آب دریاچه تأثیر می گذارد، مانند فرآیندهای درون دریاچه (شامل متابولیسم دریاچه، تجزیه مواد آلی، بارش کلسیت، و تبادل با CO اتمسفر).
۲) و محیط اقلیمی و جغرافیایی حوضه آبریز (شامل هوازدگی سنگ کربناته، انحلال و تنفس خاک) [
۲۲]. محیط اقلیمی و جغرافیایی در حوضه آبریز می تواند ترکیب ایزوتوپ کربن DIC آب دریاچه را با تأثیر بر CO آبی تغییر دهد.
۲ و قلیایی بودن آب ورودی به طور کلی، پنج عامل زیر بر ترکیب ایزوتوپی DIC تأثیر می گذارد.
- (۱)
-
ترکیب ایزوتوپ کربن ورودی دریاچه ترکیب ایزوتوپی ورودی دریاچه به طور مستقیم بر ترکیب ایزوتوپی دریاچه تأثیر می گذارد. این امر به ویژه در دریاچه های اگزورهیک یا دریاچه هایی با زمان نگهداری آب کوتاه قابل توجه است. در
چارا spp جامعه و
P. pectinatus منطقه رشد، δ
۱۳سی
DIC-L و δ
۱۳سی
DIC-I مقادیر همبستگی مثبت داشتند، در حالی که در
م میخ دار منطقه رشد جامعه، این مقادیر هیچ ارتباطی نشان ندادند (
شکل ۵). این به این دلیل است که
م میخ دار جامعه دور از نهرهای کوچک آب چشمه قرار داشت، جایی که تبادل ضعیف با آب چشمه صورت می گرفت.
شکل ۱ب). این نشان می دهد که δ
۱۳سی
DIC-I مقادیر عوامل کلیدی موثر بر δ بودند
۱۳سی
DIC-L ارزش های.
- (۲)
-
معاوضه با CO اتمسفر
۲. حوضچه DIC در دریاچه از طریق CO در تعادل ایزوتوپی با جو است.
۲ تبادل. طی این فرآیند،
۱۲CO غنی از C
2 ترجیحاً از سطح دریاچه به اتمسفر آزاد می شود و در نتیجه یک حوضچه DIC غنی می شود.
۱۳ج. این فرآیند تبادل کند است. بنابراین، اثر آن بر δ
۱۳سی
DIC-L این مقادیر در دریاچه های اندورئیک با زمان ماند طولانی بیشتر قابل توجه است. با این حال، در دریاچه هایی با زمان ماند کوتاه یا گردش سریع به راحتی قابل مشاهده نیست [
۲۳]. هنگام تبادل بین آب دریاچه و CO اتمسفر
۲ به تعادل می رسد، δ
۱۳سی
DIC-L محدوده مقادیر از ۱ تا ۳ ‰ [
۲۴,
۲۵].
تبادل بین DIC آب دریاچه و CO اتمسفر
۲ در دریاچه های اگزورهیک پیوسته است. در حالت تعادل، شکنش ایزوتوپی بین CO اتمسفر اتفاق می افتد
۲ و گونه های کربناته محلول، یعنی CO
2 (ق)، HCO
3–، و CO
32- [
8]، به شرح زیر است:
دمای ثبت شده با استفاده از یک دیتا لاگر سطح آب نشان داد که از ماه می تا سپتامبر ۲۰۱۳-۲۰۱۵، میانگین دمای سطح آب دریاچه GGH 17.0 درجه سانتی گراد بود. بر اساس معادلات (۱)-(۳)، در دمای متوسط سطح آب در دریاچه GGH، فاکتورهای شکنش ایزوتوپ کربن بین H
2CO
3، HCO
3–، و CO
32- و CO اتمسفر
۲ به ترتیب -۱٫۵، ۸٫۳۸ و ۵٫۸۹‰ هستند. ترکیب ایزوتوپی CO اتمسفر جهانی
۲ تقریباً -۸٫۱‰ است [
۲۶]. بنابراین، در حالت تعادل، مقادیر ایزوتوپی H
2CO
3، HCO
3–، و CO
32- در آب دریاچه به ترتیب -۹٫۶، ۰٫۲۸ و -۲٫۲۱ ‰ است. اشکال مختلف DIC δ های متفاوتی دارند
۱۳مقادیر C در تعادل ایزوتوپی. قدر δ
۱۳سی
DIC مقدار به نسبت اشکال مختلف DIC در آب دریاچه بستگی دارد که به مقدار pH آن مربوط می شود [
۲۷] (ص ۵۸۳). هنگامی که مقدار pH 5.5 باشد، ۸۰٪ از DIC در یک آب دارای CO آبی است.
۲ شکل (ق). هنگامی که PH 8.5 است، CO
2 (aq) کمتر از ۱٪ از DIC را تشکیل می دهد که عمدتاً HCO را مصرف می کند
۳– و CO
32- تشکیل می دهد. هنگامی که PH به ۱۰ می رسد، HCO
3– کمتر از ۵۰ درصد DIC را تشکیل می دهد. با این حال، CO
32- بر DIC مسلط است [
۲۷] (ص ۵۸۳). مقدار pH دریاچه GGH از ۸٫۱ تا ۱۰٫۶ متغیر است که نشان می دهد HCO
3– و CO
32- اشکال غالب DIC بودند. قابل توجه، δ واقعی
۱۳سی
DIC ارزش دریاچه GGH به طور کلی منفی تر از δ-تعادل جو بود
۱۳سی
DIC.
- (۳)
-
تجزیه مواد آلی در رسوبات دریاچه مواد آلی رسوبی در دریاچه ها شامل گیاهان آبزی بومی و بقایای آلی زمینی است که از حوزه آبخیز اطراف به دریاچه منتقل می شوند. پس از تجزیه، این ماده آلی افزایش می یابد
۱۲ترکیب DIC غنی شده با C از آب دریاچه [
۹]. تجزیه مواد آلی در دریاچه Qingmuke (یک دریاچه آب شیرین واقع در فلات Qiangtang) منجر به مقدار ایزوتوپ DIC برابر یا حتی کمتر از مقدار آب رودخانه شد. [
۱۰]. در مقابل، δ
۱۳سی
DIC-L مقادیر در دریاچه GGH به طور قابل توجهی مثبت تر از رودخانه Shazhuyu بود، که نشان می دهد تجزیه مواد آلی ممکن است تأثیر نسبتا کمی بر ترکیب دریاچه DIC داشته باشد. علاوه بر این، متان تولید شده توسط تجزیه مواد آلی منجر به δ منفی تری شد
۱۳سی
DIC ارزش. تجزیه ماده آلی می تواند باعث کاهش δ شود
۱۳سی
DIC مقادیر تا -۵۰‰ [
۲۸]. این مقدار به طور قابل توجهی کمتر از میانگین δ است
۱۳سی
DIC-L ارزش دریاچه GGH، که نشان می دهد CO
2 یا متان تولید شده از طریق تجزیه تأثیر قابل توجهی بر تغییرات فصلی یا بین سالانه در δ ندارد.
۱۳سی
DIC-L ارزش های.
در طول دوره مشاهده، میانگین ترکیب ایزوتوپی کربن ماده آلی (δ۱۳سیorg) در چارا spp جامعه -۱۶٫۰‰ بود، در حالی که مقادیر میانگین δ۱۳سیorg در P. pectinatus و م میخ کرد جوامع به ترتیب -۱۲٫۷ و -۱۱٫۴‰ بودند. اگر از اثر شکنش ایزوتوپ کربن به دلیل تجزیه مواد آلی غفلت کنیم، δ۱۳C از CO2 سپس از طریق تجزیه مواد آلی آزاد شده برابر δ است۱۳سیorg. با توجه به رابطه (۲)، اگر HCO3– شکل غالب DIC در دریاچه است، سپس مقدار ایزوتوپی تعادلی HCO3– در آب دریاچه ۰٫۲۸ ‰ است. در این مورد، میانگین δ۱۳سیDIC-L ارزش از چارا spp.، P. pectinatus، و م میخ دار جوامع به ترتیب -۱۵٫۷۲، -۱۲٫۴۲ و -۱۱٫۱۲ ‰ خواهند بود. با این حال، میانگین δ مشاهده شده۱۳سیDIC-L مقادیر برای این سه جامعه ۴/۵-، ۴/۷- و ۹/۷- بود که تأیید می کند که تجزیه مواد آلی تأثیر محدودی بر δ دارد.۱۳سیDIC-L دریاچه GGH
- (۴)
-
فعالیت فتوسنتزی دریاچه در دریاچه های بسیار پربار، فتوسنتز یک عامل کلیدی است که روی δ را تحت تاثیر قرار می دهد
۱۳سی
DIC ارزش آب دریاچه [
۲۹] (صص ۱۹۷-۲۰۷)، [
۳۰] (ص ۹۹-۱۱۸). در طول فتوسنتز، گیاهان ترجیحا جذب می شوند
۱۲C، که δ منفی بیشتری به دست می دهد
۱۳مقادیر C برای گیاهان و δ
۱۳سی
DIC بدن آب مثبت تر می شود [
۳۱]. چارافیت ها یک ماکروفیت مهم آبزی غوطه ور هستند. در مقایسه با گیاهان آوندی، کرافیت ها سرعت فتوسنتز بالاتر و سرعت تنفس کمتری دارند. جذب ترجیحی از
۱۲CO
2 برای اهداف فتوسنتزی می تواند منجر به
۱۳C-غنی سازی DIC در آب دریاچه [
۳۲]. در طول فتوسنتز شدید، CO حل شد
۲ در دریاچه آب محدود است [
۳۳]. هنگامی که این اتفاق می افتد، کرافیت ها از HCO استفاده می کنند
۳ برای فعالیت فتوسنتزی در مقایسه با گیاهان آوندی، کرافیت ها می توانند از HCO استفاده کنند
۳– برای فعالیت فتوسنتزی موثرتر [
۲۱]. با توجه به معادلات (۱) – (۳)، δ
۱۳مقادیر C HCO
3– مثبت تر از H
2CO
3 و CO
32- در آب دریاچه در مقابل، فعالیت فتوسنتزی کارافیت ها منجر به بارش کربنات در آب های اطراف می شود و CaCO غلیظ را تشکیل می دهد.
۳ لایه بندی ها [
۳۳]. این نیز منجر به
۱۳آب غنی شده با C در ناحیه رشد کرافیت ها.
ما دریافتیم که تعصب فصلی در δ
۱۳سی
DIC-L ارزش های
چارا spp جامعه در جولای (۲۰۱۲-۲۰۱۴) مثبت تر بود (
شکل ۴آ). علاوه بر این، در آغاز
چارا spp رشد (در ماه مه)، δ
۱۳سی
DIC-L ارزش از
چارا spp جامعه برابر با ارزش در پایان بود
چارا spp رشد (در ماه سپتامبر)، به ویژه در سال ۲۰۱۲٫ در مقابل، δ
۱۳سی
DIC-L ارزش ها در
P. pectinatus و
م میخ کرد جوامع هیچ فصلی نشان ندادند (
شکل ۴آ). این پدیده ممکن است به این دلیل رخ داده باشد
چارا spp نرخ فتوسنتز بالاتر و سرعت تنفس کمتری نسبت به سایر جوامع دارد [
۲۱]. پنطیکاست و همکاران [
۳۴] همچنین تغییرات فصلی در δ مشاهده شد
۱۳سی
DIC-L ارزش های
چارا spp جامعه در انگلستان Pełechaty و همکاران [
۳۳] پیشنهاد کرد که افزایش δ
۱۳سی
DIC نتیجه فعالیت فتوسنتزی شدید
چارای خام در اوایل تابستان علاوه بر این، متوجه شدیم که تفاوت در δ
۱۳سی
DIC-L مقادیر بین
چارا spp و گیاهان آوندی در ابتدا و انتهای فصل رشد در دریاچه GGH کوچکتر بودند اما در طول فصل اواسط رشد (ژوئیه) بزرگتر بودند (
شکل ۴آ). ممکن است تأثیر محدودی از فتوسنتز بر δ وجود داشته باشد
۱۳سی
DIC-L مقادیر در مناطق با گیاهان آوندی غوطه ور. این روند در ماه های خاصی مشهود نبود، به عنوان مثال، در جولای ۲۰۱۵٫ به دلیل محدودیت داده ها، نمی توانیم توضیحی برای این پدیده ارائه دهیم. با این وجود، میتوانیم به طور منطقی نتیجه بگیریم که تغییرات در δ
۱۳سی
DIC-L مقادیر آب دریاچه با شدت فعالیت فتوسنتزی در گیاهان مختلف آبزی مرتبط بود.
- (۵)
-
زمان نگهداری آب در مناطق خشک، با زمان طولانی ماندن آب دریاچه، تبخیر شدید منجر به از دست دادن ترجیحی نور می شود.
۱۲CO
2 و
۱۶O
2 ایزوتوپ ها، بازده δ مثبت تر
۱۳سی
DIC-L و اکسیژن (δ
۱۸O) ترکیبات آب دریاچه ایزوتوپی. علاوه بر این، یک همبستگی مثبت و معنادار بین δ مشاهده شد
۱۳سی
DIC-L و δ
۱۸O
L [
35]. نتایج پایش نشان داد که δ
۱۸O
L مقادیر دریاچه GGH به طور قابل توجهی از خط آب شهابسنگ جهانی منحرف شد، اما با خط تبخیر محلی سازگار بود، که نشان میدهد تبخیر روی δ را تحت تأثیر قرار میدهد.
۱۸O
L ترکیب آب دریاچه [
۱۹,
۳۶]. با این حال، این مطالعه نشان داد که δ
۱۳سی
DIC-L و δ
۱۸O
L مقادیر دریاچه GGH همبستگی نداشتند (
شکل ۶، نشان می دهد که تبخیر ممکن است تنها تأثیر حداقلی بر δ داشته باشد
۱۳سی
DIC-L ارزش دریاچه
تجزیه و تحلیل قبلی نشان می دهد که سطح دریاچه به تبادل اتمسفر CO2 و تبخیر تأثیر نسبتاً حداقلی بر δ داشت۱۳سیDIC-L; د۱۳سیDIC-I در درجه اول بر تغییرات δ تأثیر گذاشت۱۳سیDIC-L. راندمان فتوسنتزی بالای چارا spp نشان می دهد که δ مربوط به آن است۱۳سیDIC-L مقادیر روند فصلی مقادیر مثبت بیشتری را نشان دادند که مثبت تر از δ بودند۱۳سیDIC-L ارزش مناطق دارای گیاهان آوندی این نشان می دهد که فعالیت فتوسنتزی گیاهان آوندی تأثیر ناچیزی بر δ دارد۱۳سیDIC-L از آب دریاچه
۵٫۲٫ ترکیب ایزوتوپی DIC در آب های زیرزمینی حوضه GGH و رودخانه Shazhuyu
δ
۱۳سی
DIC-I و δ
۱۳سی
DIC-R مقادیر به طور قابل توجهی منفی تر از δ بود
۱۳سی
DIC-L در طول همان دوره، نشان می دهد که شکنش ایزوتوپی ناشی از تبادل اتمسفر یا فتوسنتز گیاهان آبزی پس از ورود آب های زیرزمینی به دریاچه رخ داده است. [
۲۵]. در مقایسه با δ
۱۳سی
DIC-I ارزش، δ
۱۳سی
DIC-R به طور قابل توجهی مثبت تر بود، احتمالاً زیرا رودخانه Shazhuyu از طریق رواناب سطحی و همچنین تبادل مکرر CO2 اتمسفر تشکیل می شود.
۲ با آب های سطحی نسبت به آب های زیرزمینی.
همبستگی مثبتی بین δ مشاهده شد
۱۳سی
DIC-I و δ
۱۳سی
DIC-R (
n = 17،
r2 = 0.46 و
پ < 0.01). علاوه بر این، با توجه به اینکه آب زیرزمینی منبع اصلی آب برای دریاچه GGH است، δ
۱۳سی
DIC-I عامل اصلی موثر بر δ بود
۱۳سی
DIC-L مقادیر آب دریاچه (نگاه کنید به
بخش ۵٫۱). بنابراین، ما بیشتر عوامل تأثیرگذار δ را تجزیه و تحلیل کردیم
۱۳سی
DIC-I.
سه گونه اصلی DIC در بدنه های آبی CO هستند
۲، CO
32-، و HCO
3–. در این مطالعه از روش تیتراسیون برای تعیین ترکیب DIC آب زیرزمینی در حوضه GGH استفاده شد. HCO
3– شکل غالب DIC بود. تحقیقات بیشتر نشان داده است که منبع اولیه HCO است
۳– در آب های زیرزمینی حوضه Gengahai و رودخانه Shazhuyu هوازدگی شیمیایی سنگ ها، به ویژه سنگ های کربناته است. [
۳۷]. بر اساس معادله واکنش برای هوازدگی شیمیایی، CO
2 جزء ضروری این فرآیند است. CO محلول
۲ در آب های زیرزمینی از شار اتمسفر، تنفس خاک حوضه و تجزیه مواد آلی سرچشمه می گیرد. CO اتمسفر
۲ معمولا δ دارد
۱۳مقادیر C تقریباً -۸‰ [
۲۵]، که نسبتاً پایدار است. δ
۱۳مقادیر C CO خاک
۲ از مناطق با C
3 و سی
۴ محدوده گیاهان از -۳۲ تا -۲۰‰ [
۳۸] و -۱۷ تا -۱۹‰، به ترتیب. δ
۱۳مقدار C HCO
3– از انحلال کربنات در طول هوازدگی زیرسطحی تقریباً ۰‰ است [
۳۹]. تعادل ایزوتوپی بین CO
2 و HCO
3– از منابع مختلف می توان از طریق واکنش مبادله زیر به دست آورد:
ضریب شکنش CO
2 و HCO
3– در CO
2-HCO
3– سیستم در خاک تقریباً ۱۰‰ است [
۲۵]. پس از خاک CO
2 در آب حل می شود، δ آن است
۱۳مقدار C منفی تر از HCO می شود
۳–. با این حال، انحلال سنگ کربنات δ را افزایش می دهد
۱۳مقدار C HCO
3–. منبع کربنی که بر ترکیب ایزوتوپی DIC در آب های زیرزمینی تأثیر می گذارد شامل دو جزء است: (۱)
۱۳C از هوازدگی و انحلال سنگهای کربناته که دارای نسبت ایزوتوپی مثبت تری است. و (۲)
۱۲C از CO
2 از طریق تنفس خاک تولید می شود که نسبت ایزوتوپ منفی تری دارد. بنابراین، سهم نسبی این دو منبع کربن به DIC آب های زیرزمینی، ترکیب δ را تعیین می کند
۱۳سی
DIC-I در حوضه GGH.
۵٫۳٫ پیامدهای ترکیب ایزوتوپی DIC آب دریاچه بر چرخه کربن
اکوسیستم های دریاچه اجزای فعال چرخه جهانی کربن هستند زیرا به طور مداوم کربن را از طریق فرآیندهای بیولوژیکی مختلف، از جمله فتوسنتز، فعالیت شبکه غذایی، و تخریب باکتری ها تثبیت و آزاد می کنند. [
۱,
۴۰]. DIC و ایزوتوپهای آن ابزار مهمی برای روشن کردن چرخه کربن اکوسیستمهای دریاچه هستند. [
۱۰,
۱۱,
۱۸,
۳۰,
۴۱] (ص ۹۹-۱۱۸). استریگل و همکاران [
۴۲] دریافتند که در طول دوره ذوب یخ، میانگین δ
۱۳سی
DIC-L ارزش در ۱۳۲ دریاچه آب شیرین در مناطق معتدل و سرد ‰ -۱۴ بود. به طور مشابه، Bade و همکاران. [
۲۲] گزارش داد که میانگین δ
۱۳سی
DIC-L ارزش در ۱۰۸ دریاچه آب شیرین در مناطق مختلف -۱۵‰ بود. در دریاچه های آب شیرین، فتوسنتز گیاهان آبزی و تجزیه مواد آلی در رسوبات، اجزای فعال چرخه کربن هستند. [
۱۰]. در دریاچه های آب شیرین در فلات Qiangtang، تغییرات δ
۱۳سی
DIC-L همچنین نشان داد که تجزیه مواد آلی به طور قابل توجهی به چرخه کربن اکوسیستم دریاچه کمک می کند. [
۱۰]. با این حال، لی و همکاران. [
۱۰] دریافت که δ
۱۳سی
DIC-L ارزش دریاچه های اندورهیک در فلات Qiangtang نسبتا بالا بود، نزدیک به δ
۱۳سی
DIC-L مقادیر CO متعادل
۲ در تبادل آب به اتمسفر
. بنابراین، سطح آب به CO اتمسفر
۲ تبادل چرخه کربن را در دریاچه های اندورهیک در فلات Qiangtang هدایت می کند [
۱۰].
δ
۱۳سی
DIC-L ارزش دریاچه GGH به طور قابل توجهی از δ فراتر رفت
۱۳سی
DIC مقادیر دریاچه های آب شیرین (>۸‰) اما منفی تر از دریاچه های فلات Qiangtang بود (>-۵٫۷۱‰) [
۱۰]. این نشان می دهد که چرخه کربن دریاچه GGH به طور قابل توجهی با دریاچه ها و دریاچه های آب شیرین در فلات Qiangtang متفاوت است. تغییرات در δ
۱۳سی
DIC-L مقادیر دریاچه GGH نشان می دهد که تجزیه مواد آلی و CO آب-اتمسفر
۲ مبادله به احتمال زیاد اجزای اصلی چرخه کربن آن نیست (
بخش ۵٫۱). ورودی کربن از آب های زیرزمینی ورودی و فتوسنتز گیاهان آبزی ممکن است اجزای اصلی چرخه کربن آن باشد.
بررسیهای اخیر پوشش گیاهی نشان داده است که گیاهان خشکیزی اصلی در حوزه آبخیز GGH هستند
بیابان های درمنه،
اکسی تروپیس آسیفیلا،
Achnather می درخشد،
Orinus kokonorica، و
آگروپیرون کریستاتوم. این مشابه با حوضه آبخیز دریاچه چینگهای است [
۴۳]. δ
۱۳سی
org ارزش های
۳گیاهان C در حوضه آبخیز دریاچه چینگهای از -۲۷٫۷ تا -۲۴٫۵‰ و گیاهان خاک در حوضه دریاچه Qinghai از -۲۶٫۹ تا -۲۴٫۸ ‰ متغیر بودند. [
۴۳]. هنگامی که DIC در آب های زیرزمینی فقط از تنفس خاک و تجزیه مواد آلی منشأ می گیرد، اگر از اثر شکنش ایزوتوپ کربن به دلیل تجزیه مواد آلی غفلت کنیم، δ
۱۳سی
DIC محدوده آب زیرزمینی از -۲۷٫۷ تا -۲۴٫۵‰ است. با در نظر گرفتن شکنش ایزوتوپی بین CO
2 (aq) و HCO
3– (تقریبا ۱۰‰) [
۸]، δ
۱۳سی
DIC محدوده آب زیرزمینی از -۱۷٫۷ تا -۱۴٫۵‰ است. همانطور که قبلا ذکر شد، اکثر δ
۱۳سی
DIC ارزش آب زیرزمینی در حوضه دریاچه GGH مثبت تر از -۱۴٫۵ ‰ بود. این نشان می دهد که تنفس خاک و تجزیه مواد آلی ممکن است تنها منبع کربن برای DIC آب زیرزمینی در حوضه نباشد.
δ به طور قابل توجهی بالاتر است
۱۳سی
DIC مقادیر (تقریباً ۳- تا +۳ ‰) در آب های زیرزمینی می تواند در مناطق کارستی رخ دهد که بخشی از اتم های کربن از انحلال سنگ آهک های حوضه ناشی می شود. [
۴۴]. به عنوان مثال، δ
۱۳سی
DIC آب زیرزمینی حوضه آبریز دونگی کونا در شمال شرقی فلات چینگهای-تبت از ۰٫۹ تا ۲٫۰ ‰ متغیر است. [
۳۹]. رسوبات پالئولک که در پلیستوسن اولیه و میانی تشکیل شده اند به طور گسترده در سراسر حوضه گونگه پراکنده شده اند. [
۱۴] (ص ۱-۱۶۶). اینجا، HCO
3– از هوازدگی رسوبات پالئولیک و انحلال مواد معدنی متعاقب آن ناشی می شود که غنی شده است
۱۳ج. جریان های آب زیرزمینی HCO را انتقال می دهند
۳–، بنابراین δ مثبت بیشتری به دست می آید
۱۳سی
DIC ارزش های. ما پیشنهاد می کنیم که HCO
3– از هوازدگی رسوب پالئولیک منشأ می گیرد که بر استخر DIC آب زیرزمینی در حوضه آبخیز GGH تأثیر می گذارد و آب های زیرزمینی نسبتاً مثبت را تولید می کند.
۱۳سی
DIC ارزش های. بنابراین، تغییرات در δ
۱۳سی
DIC مقادیر آب زیرزمینی ممکن است منعکس کننده سهم نسبی دو منبع کربن در استخر DIC آب زیرزمینی باشد. یکی از منابع کربن CO است
۲ که از تنفس خاک و تجزیه مواد آلی ناشی می شود در حالی که دیگری HCO است
۳– از رسوبات کربنات پالئولیک. علاوه بر این، ما توضیح دادیم که تغییرات در δ
۱۳سی
DIC-I ممکن است تحت تأثیر هوازدگی کربناته و تنفس خاک مربوط به جانشینی پوشش گیاهی قرار گیرد. بنابراین، تغییرات در δ
۱۳سی
DIC-L مقادیر دریاچه GGH ممکن است منعکس کننده بهره وری دریاچه و چرخه کربن حوضه باشد. در آینده، هنگام تخمین بودجه کربن منطقه ای، باید شار کربن تولید شده از فتوسنتز گیاهان آبزی، ظرفیت جذب کربن ناشی از فرآیند هوازدگی سنگ در حوضه و شار کربن تولید شده توسط تنفس خاک را در نظر بگیریم.