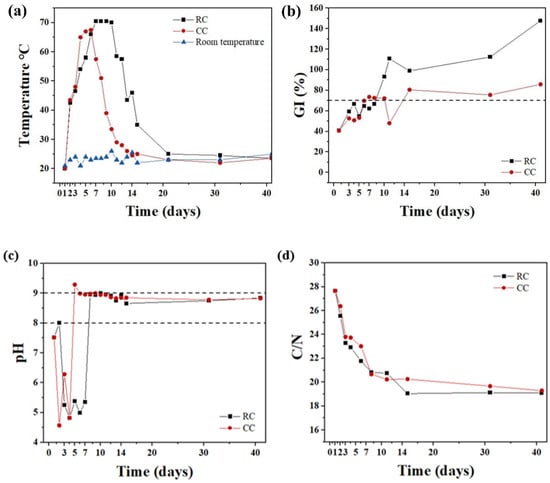
۳٫۱٫ تغییرات در پارامترهای محیطی
پارامترهای زیست محیطی در طول فرآیند کمپوست نظارت شد. تغییرات در به تصویر کشیده شده است
شکل ۱. پروفیل دمایی دو فرآیند کمپوست سازی روندهای متفاوتی را نشان داد. کمپوست سریع یک دوره مزوفیل و گرما دوست طولانی را نشان داد.
شکل ۱آ). پس از ۵ روز تخمیر، دمای CC به حداکثر ۶۷٫۵ درجه سانتیگراد افزایش یافت و به مدت ۵ روز در فاز ترموفیل (بالای ۵۰ درجه سانتیگراد) نگهداری شد. در مقابل، RC به بالاترین دمای خود (۷۰٫۵) در روز ۷ رسید و دوره گرما دوست به مدت ۹ روز ادامه داشت، از جمله ۴ روز در حالت هایپرترموفیل که برای حذف باکتری های بیماری زا از فضولات حیوانی مناسب بود. مقادیر GI برای مشاهده سمیت گیاهی تیمارهای CC و RC مورد تجزیه و تحلیل قرار گرفت.
شکل ۱ب). مقادیر GI در طول ۱۰ روز فرآیند کمتر از استاندارد بود و تا روز ۱۴ (۸۰٫۵۴٪) در CC و تا روز ۹ (۹۳٫۲۸٪) در RC بالای ۷۰٪ ثابت ماند، که نشان می دهد زمان بلوغ RC زودتر مقایسه شده است. به CC. توزیع pH به طور چشمگیری در طول زمان تغییر کرد (
شکل ۱ج). pH هر دو فرآیند به شدت از مقدار اولیه ۷٫۵۲ در طول دوره های مزوفیل به دلیل هیدرولیز مواد آلی کاهش یافت. با آزاد شدن آمونیاک، pH به ۸٫۸۳ (RC) و ۹٫۰۵ (CC) در روز ۱۴ افزایش یافت. نسبت C/N در طول دوره کمپوست کاهش یافت.
شکل ۱د). در فرآیند RC، تمایل نزولی نسبت C/N در روز ۱۴ با مقدار ۱۹٫۰۴ خاتمه یافت. در فرآیند CC، C/N تا روز ۴۰ به کاهش ادامه داد و به ۱۹٫۲۹ رسید. پس از ۱۴ روز تخمیر، C/N در RC ثابت ماند که نشان دهنده پایداری کمپوست است.
۳٫۲٫ غلظت آنتی بیوتیک و فلزات سنگین در سیستم کمپوست
آنتی بیوتیک ها و فلزات سنگین می توانند فشار انتخابی بر سرنوشت ARG ها وارد کنند. بنابراین، غلظت باقیمانده آنتی بیوتیک ها و فلزات سنگین در طول فرآیند کمپوست مورد تجزیه و تحلیل قرار گرفت. در مجموع ۲۹ آنتی بیوتیک مورد هدف شناسایی شد که متعلق به خانواده های تتراسایکلین، کینولون، سولفونامید و ماکرولید بودند. این دسته از آنتی بیوتیک ها بیشتر در طی تصفیه زباله های حیوانی مورد مطالعه قرار گرفته اند که نشان دهنده استفاده گسترده آنها در دام برای اهداف مختلف است. محتویات اولیه تمام آنتی بیوتیک ها از غلظت بالا تا کم، تتراسایکلین (۹۴%)، کینولون (۳٫۴%)، سولفونامید (۲٫۵%) و ماکرولید (۰٫۱%) بود. مقدار کل آنتی بیوتیک در مخلوط اولیه ۱٫۹۱ میلی گرم بر کیلوگرم بود که در طول دوره مزوفیل و گرما دوست به سرعت تجزیه شد.
شکل ۲آ). تیمار RC بازده تخریب بالاتر و نسبت حذف بیشتری را نشان داد. درجه حرارت بالا در درجه اول به بالاترین حذف آنتی بیوتیک ها با افزایش تخریب مواد آلی کمک کرد. علاوه بر این، با تغییر حالت های شیمیایی و برهمکنش آنها با ماتریکس آلی معدنی، بر سرنوشت مولکول های آنتی بیوتیک تأثیر گذاشت. [
۳۰]. غلظت نهایی آنتی بیوتیک ها در RC و CC 0.39 mg/kg و ۰٫۴۷ mg/kg و نسبت حذف مربوطه به ترتیب ۷۹٫۳۶ درصد و ۷۵٫۲۶ درصد بود. سولفونامیدها (۰۶۹/۸۱ درصد) و تتراسایکلین ها (۹۹۱/۷۹ درصد) بیشترین حذف را در RC نشان دادند. RC توانایی قوی تری برای حذف آنتی بیوتیک های تتراسایکلین در تمام مراحل نشان داد. با این حال، فلوروکینولون ها در سیستم کمپوست، مطابق با گزارش های قبلی، ماندگار بودند [
۳۰]. به طور مشابه، ماکرولیدها سطوح باقیمانده بالایی را پس از فرآیند کمپوست نشان دادند. شش نوع فلز سنگین در نمونههای کمپوست شناسایی شد که از فراوانی زیاد تا کم آنها روی، مس، کروم، سرب، کادمیوم، و As بودند. غلظت کل فلزات سنگین از ۵۲/۱۷۰ به ۵۱/۲۱۶ میلیگرم بر کیلوگرم (۹۴/۲۶ درصد) در RC و از ۵۲/۱۷۰ به ۷۲/۲۱۷ میلیگرم بر کیلوگرم (۹۷/۲۷ درصد) در فرآیند CC پس از ۴۰ روز کمپوستسازی افزایش یافت.
شکل ۲ب). یافتههای مشابهی نیز قبلاً گزارش شده بود، که در آن محتوای کل فلزات سنگین پس از کمپوست به دلیل کاهش وزن ناشی از تخریب پسماندهای آلی ۱۰ تا ۳۰ درصد غنیسازی شد. [
۳۱].
۳٫۳٫ سرنوشت ARGها و MGEها در فرآیندهای CC و RC
تغییرات ARGs و MGEs در طول فرآیند کمپوست سازی در هر دو تیمار نشان داده شده است
شکل ۳. ما ۳۵ زیرگروه ARG مقاوم در برابر آنتیبیوتیکها، تتراسایکلین، سولفونامید، کلرامفنیکل، ماکرولید لینکوزامید و استرپتوگرامین (MLS)، کینولونها، آمینوگلیکوزید و بتالاکتاماز را هدف قرار دادیم. در میان ژن های هدف علاوه بر
mcr-1 و
qnrA ژن ها، ۳۳ زیرگروه ARG در نمونه ها شناسایی شد. پنج MGE از جمله هدف قرار گرفتند
intI1،
intI2،
Tn916/1545،
ISCR1، و
tnpA-1. این MGE ها اغلب در فرآیند کمپوست گزارش شده اند [
۳۲,
۳۳]، ولی
Tn916/1545 در این مطالعه شناسایی نشد. میانگین غلظت ARGs در مخلوط اولیه ۱۰×۱۹/۱ بود
۹ کپی / گرم وزن خشک ژن های مقاومت به کلرامفنیکل و تتراسایکلین در ابتدا غالب ترین ARG ها بودند که ۷۰٫۱۸٪ از کل را تشکیل می دادند که ممکن است به استفاده بیش از حد از آنتی بیوتیک ها در مزارع خوک مربوط باشد. [
۳۴]. فراوانی مطلق اولیه MGE ها ۱۰×۴٫۰۵ بود
۸ کپی بر گرم وزن خشک و زیرگروه MGE
tpnA-1 در بیش از ۷۰٪ از کل غالب بود و پس از آن
intI1 و
intI2.
در طول فرآیندهای کمپوست سازی، فراوانی ARGs و MGEs هدف، الگوهای تنوع مشابهی را در هر دو تیمار به تصویر میکشد. با غنیسازی دما، فراوانی ARGs و MGEs در هر دو تیمار کاهش یافت. در روز ۱۰، تیمارهای RC حداکثر حذف MGE ها را نشان دادند (۶٫۶۲ × ۱۰
۷ کپی بر گرم وزن خشک (۹۴٫۴%) و ARGs (1.30 × ۱۰)
۷ کپی بر گرم وزن خشک (۹۶٫۸%). ژنهای مقاوم به بتالاکتاماز، کلرامفنیکول و کینولون حداکثر حذف را در هر دو تیمار نشان دادند، با بتا-لاکتاماز که ۱۰۰٪ در تیمارهای RC حذف شد. علاوه بر این، زیرگروه های ARG
tetQ،
tetB،
tetG،
اینجا،
tetC،
sul2،
cfr،
خوب،
ermB،
lnuA،
شش،
ermF،
ermA،
qnrS،
qnrD، و
oqxA در طول دوره ترموفیل به طور کامل حذف شدند. با این حال، ARGs در طول مراحل خنککننده و بلوغ برگشتند. یافتههای مشابهی قبلاً گزارش شده بود، که در آن ARGها حداکثر کاهش را در طول فاز ترموفیل و تجدید حیات پس از آن نشان دادند. [
۱,
۱۶]. ARG ها و MGE ها در CC از روز ۷ به بعد برگشت کردند و به تدریج به ۵٫۰۵ × ۱۰ بهبود یافتند.
۸ و ۵٫۷۹ × ۱۰
۷ راندمان حذف نهایی ARGs و MGEs در روز ۴۰ در CC به ترتیب ۶۰% و ۸۵% و در RC 85% و ۹۷% بود که بالاتر از موارد گزارش شده قبلی است. در طی تأثیر تنظیمات مختلف دما بر حذف ARGها، مشاهده شد که فراوانی کل ARGها به طور کلی کاهش یافته است. متوسط راندمان حذف در تیمارهای متوسط (۵۸ درجه سانتیگراد) و دمای بالا (۶۸ درجه سانتیگراد) ۳۲٫۹-۳۴٫۰٪ بود در حالی که زیرگروه های متعدد ARG، مانند
erm(F)، ۲ تا ۵ بار در روز ۴۲ غنی شدند [
۲۳]. حذف حداقل ARGs در CC را می توان به حذف محدود آنتی بیوتیک ها نسبت داد، که احتمالاً فشار انتخابی بر ARG ها تحمیل می کند و باعث حفظ و احیای مجدد آنها در مراحل بعدی می شود. علاوه بر این، دمای غنی شده ممکن است میزبان اولیه ARGs در RC را حذف کرده باشد، زیرا قبلاً گزارش شده است که تنظیم اولیه در دمای کمپوست منجر به حداکثر حذف ARG از طریق تنظیم ترکیب میکروبی اولیه می شود. [
۱۲]. علاوه بر این، الگوهای تغییرات مشابه برای MGE ها و ARG ها نشان می دهد که سرنوشت ARG ها به طور جدایی ناپذیری با MGE ها مرتبط است. چندین زیرگروه MGE که در طول دوره خنکسازی احیا شدهاند ممکن است منجر به بازگشت کمتری در ARGها در فرآیند RC شود. نتایج ما نشان میدهد که بهینهسازی دمای کمپوست میتواند به حداکثر کاهش ARGs و MGEs دست یابد و در عین حال از بازگشت ARG در مراحل بعدی جلوگیری کند.
۳٫۴٫ ترکیب و جانشینی جوامع میکروبی
عوامل بیولوژیکی به عنوان مستقیم ترین عوامل مؤثر بر سرنوشت ARG ها در نظر گرفته می شوند [
۱]; بنابراین، ترکیب و جانشینی جامعه میکروبی بیشتر مورد تجزیه و تحلیل قرار گرفت. تیمارهای گرمایش خارجی بر اساس PCoA (تجزیه و تحلیل مختصات اصلی) بر اساس فاصله Bray-Curtis (در سطح شاخه) از روز ۳ به جوامع باکتریایی متمایز منجر شد (
شکل ۴آ). تنوع α (
شکل ۴ب) کمترین مقادیر را در طول دوره گرمادوست نشان داد که یک گرایش تکاملی رایج در کمپوست است. [
۳۵]. تجزیه و تحلیل بیشتر از جانشینی میکروبی در طول هر دو فرآیند کمپوست نشان داد که تمام توالیها به ۳۴ فیلا طبقهبندی شدند و فیلاهای غالب در هر دو تیمار Firmicutes، Proteobacteria، Actinobacteria و Bacteroidota بودند که نسبتی از ۷۸٫۰% تا ۹۹% را شامل میشوند.
شکل ۴ج). بیشتر پروتئوباکتریها و باکتریهای باکتریایی مزوفیل هستند و بنابراین در مراحل اولیه غالب باقی ماندند. بنابراین، با توجه به رابطه نزدیک بین پروتئوباکتری ها و تجزیه مواد آلی مولکولی کوچک و کانی سازی مواد آلی نیتروژن دار [
۳۲,
۳۶]استراتژی طولانی شدن دوره مزوفیلیک برای تخریب کامل مواد آلی ضروری بود. در مقابل، Firmicutes مقاوم در برابر حرارت هستند [
۳۷] و در مرحله هایپرترموفیل غالب باقی ماند. در مرحله سرد شدن، نسبت اکتینوباکتری ها به تدریج افزایش یافت که می تواند سلولز و لیگنین را تجزیه کند. [
۳۸]. وانگ و همکاران [
۳۹] همچنین پیشنهاد کرد که فراوانی نسبی اکتینوباکتری ها در مراحل بعدی نشانگر بلوغ کمپوست است.
در سطح کلاس، ترکیب میکروبی در تیمارهای RC و CC به طور قابل توجهی متفاوت بود (
شکل ۴د). در شمع های اولیه، طبقات غالب بودند
باسیل،
اکتینوباکتری ها،
گاماپروتئوباکتری ها،
باکتریودیا،
کلستریدیا، و
سیانوباکتری ها، ۹۰٪ از کل ترکیب را تشکیل می دهد.
باسیلکه متعلق به Firmicutes هستند و باکتری های مقاوم در برابر حرارت هستند [
۴۰]با افزایش دمای کمپوست در روز ۳ در CC و در روز ۵ در RC از ۲۰% به ۸۰% افزایش یافت. باسیل ها تا روز ۱۴ کلاس غالب در RC باقی ماندند و ۴۳ درصد از جامعه میکروبی را تشکیل می دادند. متقابلا،
اکتینوباکتری ها،
لیمنوکوردیا،
آلفاپروتئوباکتری ها، و
گاماپروتئوباکتری ها به تدریج از روز ۱۴، با فراوانی نسبی کل ۴۷٪ در RC، سوله های زیست محیطی بیشتری را اشغال کرد. علاوه بر این، با کاهش دما در CC، نسبت
باسیل به تدریج کاهش یافت، در حالی که
اکتینوباکتری ها،
گاماپروتئوباکتری ها، و
باکتریوئیدیا در روز هفتم، با نسبت کل ۵۵ درصد، کلاس های غالب شدند. در روز ۴۰، تنوع جامعه باکتریایی بالاتر در فرآیند RC به دلیل رشد مجدد گونههای باکتریایی خاص مشاهده شد. این نتایج نشان داد که RC و CC ترکیبات میکروبی و جانشینی متفاوتی دارند، که ممکن است یکی از توضیحهای تفاوت در تغییرات ARGs بین دو فرآیند کمپوستسازی باشد.
۳٫۵٫ میزبان بالقوه در بازگشت مجدد ARGS نقش داشته است
الگوی هموقوع غیرتصادفی عوامل زیستی در هر دو فرآیند با تحلیل شبکه بیشتر مورد تجزیه و تحلیل قرار گرفت.
شکل ۵a,b) که می تواند میزبان بالقوه ARGها در کمپوست را نشان دهد. الگوی وقوع همزمان ARGs و MGEs و باکتری های میزبان بالقوه در CC به سه ماژول تقسیم شد که ۴۲٪، ۳۸٪ و ۲۰٪ را شامل می شود. میکروب ها در یک ماژول با ARG و MEG ها ممکن است میزبان های بالقوه باشند و ARG ها و MGE ها حتی ممکن است میزبان های مشابهی داشته باشند.
باسیل همبستگی را نشان داد
ermA و
tetC (
پ < 0.05).
گاماپروتئوباکتری ها به طور قابل توجهی با ۱۲ زیرگروه ARG همراه بود (
عمه A،
tetM،
dfrA1،
cmlA1،
cmlA5،
cfr،
floR،
ermX،
شش،
qnrS،
aac(6') -Ib، و
strB) و سه زیرگروه MGE (
بین المللی ۱،
بین المللی ۲، و
tpnA-1). به همین ترتیب،
کلستریدیا،
ساکاریمونادیا،
سیانوباکتری ها، و
کمپیلوباکتری ها ممکن است میزبانهای بالقوه زیرگروههای مختلف ARG باشند که ارتباطی با آن نشان میدهند
عمه A،
tetB،
اینجا،
tetM،
tetW،
tetQ،
dfrA1،
cmlA1،
cmlA5،
cfr،
ermX،
خوب،
شش،
qnrS،
aac(6') -Ib، و
strB. همبستگی مثبت قابل توجهی نیز برای مشاهده شد
اسپیروکتیا و
tetB،
tetM،
tetW،
tetQ،
خوب،
شش، و
qnrS (
پ < 0.01).
شکل ۵a الگوی همزمانی ARGs و MGEs و باکتری های میزبان بالقوه در RC را نشان می دهد که به سه ماژول تقسیم شده است. ماژول های ۱ تا ۳ ۳۹٫۵۸%، ۳۷٫۵% و ۲۲٫۹۲% را به خود اختصاص دادند. یک رابطه قوی (
پ < 0.05) بین پنج زیرگروه ARG (
عمه A،
tetC،
cmlA5،
خوب، و
sul2) و
کلستریدیا مشاهده شد، در حالی که
لیمنوکوردیا،
میکسوکوکسیا،
پلیانژیا،
سیانوباکتری ها،
اسپیروکتیا، و
اسید میکروبی مشخص شد که به طور قابل توجهی با چندین ARG مرتبط است (
strA،
ermA،
tetW،
ermX،
floR،
blaTEM،
tetB،
strB،
aac (6′)-Ib،
خیلی بی، و
dfrA1) و یک MGE (
tpnA-1). جالب توجه است، ۱۱ زیرگروه ARG، از جمله
ermQ،
شش،
ermB،
tetQ،
tetM،
اینجا،
lnuA،
qnrD،
qnrS،
tetX، و
cfrو دو اینتگرون،
intI1 و
intI2، با باکتری ها مرتبط بودند
کلروفلکسی و
اکتینوباکتری ها (
پ <0.05)، به ترتیب.
در این مطالعه اکتینوباکتری ها، فیرمیکوت ها، پروتئوباکتری ها و کلروفلکسی میزبان های اصلی ARG بودند که در مطالعات قبلی نیز به طور گسترده گزارش شده است. [
۴۱,
۴۲]. مشخص شد که Proteobacteria و Firmicutes غالب ترین باکتری های حامل ژن های مقاومت به تتراسایکلین هستند. [
۴۱]. این
tetC،
tetX،
sul2، و
dfrA7 احتمالاً در طول کمپوست سازی کود گاوی به کلروفلکسی وابسته بودند [
۴۳]. علاوه بر این، نتایج همچنین نشان داد که برخی از باکتری ها مانند
سیانوباکتری ها،
Spirochaetota، و
کمپیلوباکتروتا، در کمپوست غالب نبودند و ممکن است ARG را نیز در خود جای دهند. تجزیه و تحلیل بیشتر از تغییرات در فراوانی نسبی میکروب های میزبان بالقوه (
شکل ۵ب) نشان داد که بازگشت مجدد ARGها به طاقچه اکولوژیکی اشغال شده توسط میزبان در طول مرحله سرد شدن و بلوغ بستگی دارد. فراوانی نسبی هر میزبان بالقوه در RC از ۳۰٪ تجاوز نکرد و بازگشت جزئی بعد از روز ۱۰ عمدتاً ناشی از
اکتینوباکتری ها. تنها هفت میزبان ممکن در سی سی وجود داشت، جایی که
باسیل و
گاماپروتئوباکتری ها در مراحل مختلف کمپوست سازی غالب است. به ویژه،
باسیل ممکن است ARG ها را با مزیت مقاوم در برابر حرارت و فراوانی نسبی محافظت کند
گاماپروتئوباکتری ها از روز ۵ به بعد افزایش یافت، که فرض می شد میزبان اصلی چندین ARG در مراحل بعدی باشد.
به طور خلاصه، همزمانی غیر تصادفی باکتریهای بالقوه، MGEs و ARGs اغلب در طول کمپوستسازی مشاهده شد. در RC، غنیسازی میزبانهای بالقوه در طول دوره خنککننده اتفاق نیفتاد و در نتیجه از بازگشت ARG جلوگیری کرد. بنابراین، با حذف انتخابی میزبانهای بالقوه کلیدی از طریق کنترل دما، تجدید حیات ARGs در مراحل بعدی کمپوستسازی میتواند کاهش یابد.
۳٫۶٫ درایورهای درجا ARGها در فرآیند کمپوست سازی
سرنوشت ARGها در کمپوست سازی به دلیل شرایط کمپوست سازی، استرس خارجی و عوامل بیولوژیکی پیچیده است. [
۱]. بر اساس تجزیه و تحلیل افزونگی (RDA)، همبستگی بین ARGs و پارامترهای محیطی، موادی که می توانند باعث فشار انتخاب شوند (آنتی بیوتیک ها و فلزات سنگین)، MGE ها و جوامع میکروبی بیشتر تشریح شدند.
شکل ۶). نه زیرگروه ARG (
floR،
strB،
tetW،
tetM،
عمه A،
dfrA1،
cmlA5،
sul1، و
aac(6') -Ib) و نه گروه باکتریایی غالب شامل Firmicutes، Proteobacteria، Actinobacteriota، Bacteroidota، Myxococcota، Cyanobacteria، Spirochaetota، Chloroflexi و Desulfobacterota، برای تجزیه و تحلیل انتخاب شدند. همانطور که با طول و زاویه متغیرها در RDA مشخص شد، مهمترین عامل محیطی تعیین کننده برای سرنوشت ARGها دما بود. دما با همه ARG ها همبستگی نشان داد، که نشان می دهد دمای بالا برای حذف ARG مفید است. نتایج مشابهی نیز قبلاً به دست آمده بود که منجر به این نتیجه شد که دما نقش کلیدی در سرنوشت ARG داشته است. [
۳۶,
۴۴]. دلایل اصلی این امر عبارتند از ترویج آنتی بیوتیک ها، آفت کش ها و تجزیه مواد آلی در دماهای بالا، در نتیجه کاهش فشار انتخابی. [
۲۲]. علاوه بر این، دمای بالا به طور مستقیم میزبان های باکتریایی مزوفیل و بی هوازی ARGs و MGE ها را از بین می برد. [
۴۵]. علاوه بر این، شرایط گرما دوست با مهار MGE ها، انتقال افقی ژن ARGs را تضعیف می کند. [
۴۶]. نسبت C:N و TOC با اکثر ARG ها همبستگی مثبت و همبستگی منفی با
sul1در حالی که pH نتایج معکوس داشت. تایید شد که
بلاTEM-1 و
بلاAmpC در طول کمپوست کود خوکی با TOC همبستگی مثبت داشت [
۴۷] و برخی از ARG ها با pH همبستگی منفی داشتند [
۴۴]، به ویژه
tetW،
tetM، و
عمه A [
36]، در حالی که
sul1،
sul2، و
بلاCTX- M با مقدار pH همبستگی مثبت داشت [
۹]. این نتایج با این مطالعه مطابقت دارد.
فشار انتخاب مستقیم ناشی از آنتی بیوتیک ها و فشار انتخاب سینرژیک ناشی از فلزات سنگین نیز به افزایش فراوانی ARG در محیط کمک می کند که ممکن است مانع حذف ARG شود. [
۹,
۴۳]. در این مطالعه استرس خارجی بیشتر به دلیل وجود آنتی بیوتیک بود. به جز
sul1 در CC همچنین فلزات سنگین مس، روی، اسانس و سرب رابطه مثبتی با آن داشتند
sul1 در فرآیند CC لو و همکاران [
۴۸] دریافت که محتویات مس، روی و سرب با فراوانی همبستگی مثبت دارند
sul1،
sul2، و
sul3 ژن ها در یک مصب ARG ها توسط باکتری های میزبان حمل شده و از طریق MGE ها تکثیر می شوند. بنابراین، پارامترهای زیستی به شدت با تغییرات در پروفایل ARG در طول کمپوست همبستگی دارند. MGE ها یک همبستگی مثبت نزدیک با اکثر ARG ها نشان دادند. توضیح احتمالی برای این موضوع این است که MGE ها و ARG ها باکتری های میزبان یکسانی دارند و MGE ها عمدتاً مسئول انتشار ARG هستند. [
۱]. بنابراین، مهار MGE ها برای کنترل بازگشت مجدد ARG ضروری است. همبستگی مثبتی بین سیانوباکترها، دسولفوباکتروتا و اسپیروکاتوتا و اکثر ARGها مشاهده شد که ممکن است باکتری میزبان بالقوه مربوط به ARG را نشان دهد.
با در نظر گرفتن تمام عوامل زنده و غیر زنده، یک مدل معادله ساختاری ایجاد شد تا اثرات مستقیم و غیرمستقیم آنها بر تغییرات ARGها آشکار شود. مکانیسم های حاکم بر سرنوشت ARGs در هر دو فرآیند کمپوست سازی پیچیده بود.
شکل ۷). بر اساس تجزیه و تحلیل SEM، ما سه عامل را شناسایی کردیم که مانع از حذف ARG شد. اولا، در حالی که تغییرات قابل توجهی در شرایط محیطی در طول هفته اولیه کمپوست می تواند بخش قابل توجهی از میکروارگانیسم ها را ریشه کن کند، وجود میکروارگانیسم های مقاوم در برابر حرارت از ARG ها محافظت می کند و امکان تکثیر آنها را از طریق انتقال عمودی ژن فراهم می کند. [
۴۱,
۴۲]. ثانیا، فرآیند انتقال ژن افقی با واسطه MGE فعال باقی می ماند و حرکت ARGها را تسهیل می کند، مانند
sul1 ژن واقع در بخش ۳' حفاظت شده از
intI1 [
14,
44]. ثالثاً، کمپوست کردن فلزات سنگین را از بین نمی برد و آنتی بیوتیک ها را به طور کامل تجزیه نمی کند و منجر به فشار انتخابی ژن می شود که ژن های مقاوم را هدف قرار داده و حفظ می کند. [
۴۹,
۵۰]. همه عوامل بالقوه الگوی تغییرات ARGs را تعیین کردند، اما تفاوت در اهمیت نسبی این عوامل است. SEM نشان داد که MGEها قویترین اثر را بر فراوانی ARG در RC داشتند، در حالی که پارامترهای محیطی تعیینکننده اصلی سرنوشت ARGs در CC بودند. با این حال، اثر مستقیم غالب بر تغییرات ARG در هر دو فرآیند، فراوانی MGE بود. این نشان می دهد که فرکانس پایین انتقال ژن افقی به طور مستقیم انتشار ARGs را محدود می کند.
کنترل دما به طور قابل توجهی تأثیر پارامترهای محیطی را بر سایر عوامل بالقوه تشدید کرد و در نهایت کنترل سرنوشت آنتی بیوتیک ها را تقویت کرد. به طور مشخص، دما علاوه بر اثرات مستقیم، حذف MGEs و آنتیبیوتیکها را نیز افزایش داد و بر ساختار جامعه میکروبی تأثیر گذاشت. این نشان میدهد که کنترل دما میتواند از همه جنبهها از بازگشت ARG جلوگیری کند، که یک استراتژی امیدوارکننده برای مهار بازگشت مجدد ARGs در مرحله پایانی کمپوست است.